La Configuración Electrónica
Bloques de la tabla periódica de los elementos
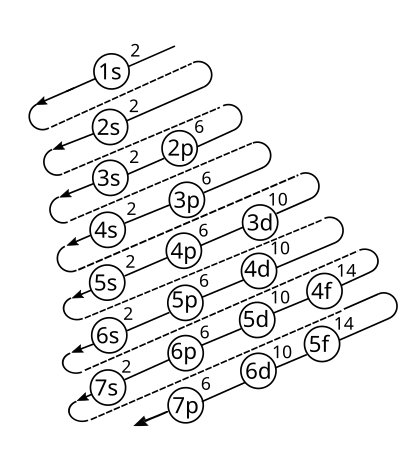
La forma de la tabla periódica de los elementos está íntimamente relacionada con la configuración electrónica de los átomos de los elementos. Por ejemplo, todos los elementos del grupo 1 tienen una configuración de [E] ns1 (donde [E] es la configuración del gas inerte correspondiente), y tienen una gran semejanza en sus propiedades químicas. La capa electrónica más externa se denomina "capa de valencia" y (en una primera aproximación) determina las propiedades químicas. Conviene recordar que el hecho de que las propiedades químicas sean similares para los elementos de un grupo fue descubierto hace más de un siglo, antes incluso de aparecer la idea de configuración electrónica.8 No está claro cómo explica la regla de Madelung (que más bien describe) la tabla periódica,9 ya que algunas propiedades (tales como el estado de oxidación +2 en la primera fila de los metales de transición) serían diferentes con un orden de llenado de orbitales distinto. Por tanto las configuraciones electrónicas determinarán las propiedades de combinación química
Principio de exclusión de Pauli
Esta regla nos dice que en un estado cuántico solo puede haber un electrón. De aquí salen los valores del espín o giro de los electrones que es 1/2 y con proyecciones .
También que en una orientación deben caber dos electrones excepto cuando el número de electrones se ha acabado, por lo cual el orden que debe seguir este ordenamiento en cada nivel es primero los de espín positivo (+1/2) y luego los negativos.
El principio de exclusión de Pauli fue un principio cuántico enunciado por Wolfgang Ernst Pauli en 1925. Establece que no puede haber dos fermiones con todos sus números cuánticos idénticos (esto es, en el mismo estado cuántico de partícula individual). Perdió la categoría de principio, pues deriva de supuestos más generales: de hecho, es una consecuencia del teorema de la estadística del spin. El principio de exclusión de Pauli sólo se aplica a fermiones, esto es, partículas que forman estados cuánticos antisimétricos y que tienen espín semientero. Son fermiones, por ejemplo, los protones, los neutrones y los electrones, los tres tipos de partículas subatómicas que constituyen la materia ordinaria. El principio de exclusión de Pauli rige, así pues, muchas de las características distintivas de la materia. En cambio, partículas como el fotón y el (hipotético) gravitón no obedecen a este principio, ya que son bosones, esto es, forman estados cuánticos simétricos y tienen espín entero. Como consecuencia, una multitud de fotones puede estar en un mismo estado cuántico de partícula, como en los láseres.

